学位
博士(医学) 京都大学
専門分野
分子生物学、病態医化学
学 歴
1984年 筑波大学医学専門学群入学
1990年 同上卒業
京都大学京都大学大学院医学研究科博士課程入学(生理系専攻)
1994年 同上修了(博士(医学))
職 歴
1994年 京都大学病院 検査部・医員
1995年 日本学術振興会・特別研究員(COE)
1996年 徳島大学酵素科学研究センター・助手
1997年 徳島大学分子酵素学研究センター・助手(改組にて)
徳島大学医学部医学科講師(非常勤)
1998年 平成10年度文部省在外研究員(創造開発研究)(カナダ トロント大学出張)
1999~2000年 平成11年度文部省長期在外研究員(甲種研究員)(カナダ トロント大学出張)
2001年 徳島大学分子酵素学研究センター・助教授
徳島大学歯学部講師(非常勤)
2007年 徳島大学疾患酵素学研究センター・准教授(改組にて)
徳島大学ヘルスバイオサイエンス研究部栄養学研究科講師(非常勤)
2014年 徳島文理大学健康科学研究所、人間生活学部教授
徳島大学疾患酵素学研究センター教授(客員・兼任~2016年3月まで)
2016年 徳島大学大学院医科学教育部客員教授(兼任)
(現在に至る)
研究要旨
遺伝素因とともに高次生命現象の理解に必須と考えられている生物の環境応答機構を特に細胞傷害性ストレス応答機能に注目して解析している。
1.研究テーマ
栄養のインバランスがもたらす疾患の発症機構を分子レベルで明らかにすることを目指して、バイオ技術を駆使した基礎研究を展開しています。
栄養摂取過多や不足によるストレスが種々の代謝性疾患や炎症性疾患、あるいは精神疾患などの誘因となることが明らかとなってきています。
ストレスが体に及ぼす直接的な作用としては、免疫系への影響があります。免疫は病原体などの異物からの侵入に対して生体を防御する重要な働きをしているばかりでなく、がん、生活習慣病、自己免疫疾患など現代病の発生や悪性化にも深い関わりを持っています。特に生活習慣病との関連で見た場合、肝臓に於ける免疫システム(肝免疫系)が重要な役割を担っています。肝臓には、消化管からの抗原リッチな血液が門脈を通して流れ込みます。肝臓はこれらの抗原に対する免疫器官として重要な役割を担っています。類洞(sinusoid)と呼ばれる肝臓内の血液の通り道には、NK細胞やNKT細胞といった免疫担当細胞が、門脈から入り込んだ抗原に対する最初の障壁として立ちはだかります。またクッパー細胞(肝在住マクロファージ)や樹状細胞といった抗原提示細胞も肝免疫の重要な役割を担っています。別の見方をすれば、肝臓は我々の体の中で最もストレスに晒されている器官であると言えます。また肝臓は消化管から吸収した栄養を代謝する中心器官でもあります。このことから、肝臓への過度のストレスはしばしば代謝異常として現れます。以上より、肝免疫系の不全が糖代謝異常や脂質代謝異常をもたらすと言うことは容易に想像が付きます。
我々は、食事・栄養摂取がもたらす肝臓への影響と、肝免疫との関係を研究しています。
2.これまでの研究概要
現代人の生活スタイルにより発症が促進される生活習慣病は、現代社会における大きな問題となっている。その代表的なものである高血圧・脂質異常症・糖尿病・肥満はそれら自体が生命にかかわる重篤な結果を引き起こしうるのに加え、また近年これらの背景のもとでの発症が注目されてきたNAFLD(非アルコール性脂肪性肝障害)やNASH(非アルコール性脂肪性肝炎)、あるいはこれらから進展発症する肝癌も生活習慣病の範疇の中で大きな位置を占めるようになってきた。これらの発症要因となる因子は、偏食、運動不足、喫煙、ストレスなど多く知られているが、これらの因子に対してどのような反応が生体内に起こり、疾病発症へ至るのかについては、これまで多くの研究がなされてきているが、未解明な部分も多い。生活習慣病を引き起こしうる遺伝子異常は複数報告されており、我々が単離同定したヌクリングもその一つである。ヌクリング遺伝子発現不全は、生活習慣病にカテゴライズされる種々の炎症性疾患の発症率を上昇させることがマウスの系で確認されている。ヌクリングはまたストレスにより、発現の影響を受けることが我々の研究で明らかとなってきている。ヌクリングは新規アポトーシス制御分子であり、マクロファージ系の細胞、特に肝在住マクロファージであるクッパー細胞の活性化やアポトーシスに関与しているらしいことを我々は明らかにしてきた。クッパー細胞の動態は炎症性肝疾患の発症に強い影響を及ぼすことが考えられる。このことから、環境の変化に伴うヌクリング自身の発現変動が生活習慣病の発症に影響している可能性が示唆される。ヌクリングの発現制御とそれに伴う生活習慣病の発症機構が明らかとなれば、同疾病に対する新たな治療戦略の開発への発展も期待される。
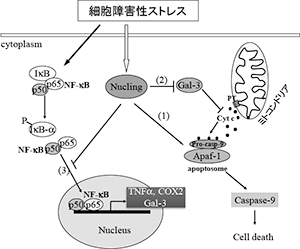
ヌクリング: マウスヌクリング遺伝子は全長1411アミノ酸をコードし、またその配列中にはアンキリンリピート、ロイシンジッパーモチーフ及び二つのt-SNARE コイルドコイルドメインといったタンパク質間相互作用に重要と思われる複数のモチーフが同時に存在する構造を有する(Sakai et al. J. Biochem. 2003, JB論文賞)。これまでの研究成果より、我々は本遺伝子のコードする蛋白分子が細胞傷害性ストレス時に誘導される複数の細胞死(アポトーシス)誘導情報伝達経路を制御していることを示す知見を得ている。ヌクリングは種々の細胞外ストレスにより細胞内に発現が誘導され、アポトーシス誘導分子Apaf-1と分子間相互作用して、そのアポトーシス誘導時の核移行及び細胞内発現を制御することにより、Apaf-1/カスパーゼ9 経路(アポトゾーム経路)の活性化に関与している(図中(2))(Sakai et al. J. Biol. Chem. 2004)。さらに、 Nuclear factor-B (NF-B)とも相互作用し、その核移行を制御することにより、NF-Bの標的である種々のアポトーシス関連遺伝子(ガレクチン3等)の転写活性を制御している(図中(3))(Liu, Sakai et al. FEBS J. 2009)。また、抗アポトーシス分子ガレクチン3との相互作用により、アポトーシス抑制経路の制御にも関与が強く示唆されている(図中(1)) (Biochem. J. 2004)。一方、ヌクリング自身がその標的であるNF-Bの転写活性によって発現誘導され、アポトーシス誘導因子として働いた後にプロテアソーム及びカスパーゼ系により分解されることを我々は明らかにした(Tran et al. J. Biochem. 2010)。このことより、細胞は傷害性ストレスにさらされると最初はNF-Bの活性化により抵抗性を示すが、持続的ストレス下ではヌクリングの発現が誘導され、アポトーシスの方へ傾くというモデルが考えられた。実際にヌクリングの欠損は細胞傷害性ストレスに対してアポトーシス障害を引き起こすことが個体レベルで種々、確認されている(Kim et al. J. Biochem. 2013)。ヌクリングの関与が示唆されるNF-B経路は、近年発がん機構への関与が注目されてきている。我々は、ヌクリングの発現異常が潜在的に乳がんを発症しやすくなることを見いだし、そのことから離乳後の乳腺退縮時のアポトーシス現象にヌクリングが重要であることを証明し、これを報告した(Dang et al. J Biol. Chem. 2015)。また肝炎に伴う肝がんの発症機構においては、肝実質細胞及びクッパー細胞におけるNF-Bの活性化及びそれに伴うアポトーシス抑制が極めて重要な役割を担っていることが明らかとなってきている。ヌクリングKOマウスでは初代培養胚性線維芽細胞においてNF-Bの持続的活性化が観察されていたが (Liu, Sakai et al. Biochem. J. 2004)、生体肝組織においても多くのヌクリングKOマウス個体においてNF-Bの持続的活性化を最近確認している。また、同KOマウスでは肝炎・肝がんの自然発症率が生後一年を経過した集団で著増することが観察されている。最近我々はこれらヌクリングKOマウスに於ける炎症性肝疾患発症の下地として、NF-B活性化異常に起因すると考えられる代謝障害が存在していることを見いだした。我々はこのヌクリング−NF-B経路による肝代謝調節機構の解明を目指して研究を行っている。
主 要 論 文
1. Dang HV, Sakai T, Pham TA, Tran DH, Yorita K, Shishido Y, Fukui K. Nucling, a novel apoptosis-associated protein, controls mammary gland involution by regulating NF-κB and STAT3. J Biol Chem. 290巻40号, 2015、24626-24635 DOI:10.1074/jbc.M115.673848
2. Tran DH, Shishido Y, Chung SP, Trinh HT, Yorita K, Sakai T, Fukui K. Identification of DNA-binding proteins that interact with the 5'-flanking region of the human d-amino acid oxidase gene by pull-down assay coupled with two-dimensional gel electrophoresis and mass spectrometry. J Pharm Biomed Anal. 116巻, 2015、94-100 DOI:10.1016/j.jpba.2015.02.031.
3. Tran DH, Shishido Y, Chung SP, Trinh HT, Yorita K, Sakai T, Fukui K. Identification of two promoters for human D-amino acid oxidase gene: implication for the differential promoter regulation mediated by PAX5/PAX2. J Biochem. 157巻5号、2015、377-387 DOI:10.1093/jb/mvu084
4. 福井 清、宍戸 裕二、頼田 和子、坂井 隆志、D-アミノ酸代謝の病態システム酵素学:統合失調症疾患感受性とD-アミノ酸酸化酵素、月刊バイオインダストリー 31巻、2014、11-16
5. Kim SM, Sakai T, Dang HV, Tran NH, Ono K, Ishimura K, Fukui K. Nucling, a novel protein associated with NF-κB, regulates endotoxin-induced apoptosis in vivo. J Biochem. 153巻1号、2013、93-101.
博士(医学) 京都大学
専門分野
分子生物学、病態医化学
学 歴
1984年 筑波大学医学専門学群入学
1990年 同上卒業
京都大学京都大学大学院医学研究科博士課程入学(生理系専攻)
1994年 同上修了(博士(医学))
職 歴
1994年 京都大学病院 検査部・医員
1995年 日本学術振興会・特別研究員(COE)
1996年 徳島大学酵素科学研究センター・助手
1997年 徳島大学分子酵素学研究センター・助手(改組にて)
徳島大学医学部医学科講師(非常勤)
1998年 平成10年度文部省在外研究員(創造開発研究)(カナダ トロント大学出張)
1999~2000年 平成11年度文部省長期在外研究員(甲種研究員)(カナダ トロント大学出張)
2001年 徳島大学分子酵素学研究センター・助教授
徳島大学歯学部講師(非常勤)
2007年 徳島大学疾患酵素学研究センター・准教授(改組にて)
徳島大学ヘルスバイオサイエンス研究部栄養学研究科講師(非常勤)
2014年 徳島文理大学健康科学研究所、人間生活学部教授
徳島大学疾患酵素学研究センター教授(客員・兼任~2016年3月まで)
2016年 徳島大学大学院医科学教育部客員教授(兼任)
(現在に至る)
研究要旨
遺伝素因とともに高次生命現象の理解に必須と考えられている生物の環境応答機構を特に細胞傷害性ストレス応答機能に注目して解析している。
1.研究テーマ
栄養のインバランスがもたらす疾患の発症機構を分子レベルで明らかにすることを目指して、バイオ技術を駆使した基礎研究を展開しています。
栄養摂取過多や不足によるストレスが種々の代謝性疾患や炎症性疾患、あるいは精神疾患などの誘因となることが明らかとなってきています。
ストレスが体に及ぼす直接的な作用としては、免疫系への影響があります。免疫は病原体などの異物からの侵入に対して生体を防御する重要な働きをしているばかりでなく、がん、生活習慣病、自己免疫疾患など現代病の発生や悪性化にも深い関わりを持っています。特に生活習慣病との関連で見た場合、肝臓に於ける免疫システム(肝免疫系)が重要な役割を担っています。肝臓には、消化管からの抗原リッチな血液が門脈を通して流れ込みます。肝臓はこれらの抗原に対する免疫器官として重要な役割を担っています。類洞(sinusoid)と呼ばれる肝臓内の血液の通り道には、NK細胞やNKT細胞といった免疫担当細胞が、門脈から入り込んだ抗原に対する最初の障壁として立ちはだかります。またクッパー細胞(肝在住マクロファージ)や樹状細胞といった抗原提示細胞も肝免疫の重要な役割を担っています。別の見方をすれば、肝臓は我々の体の中で最もストレスに晒されている器官であると言えます。また肝臓は消化管から吸収した栄養を代謝する中心器官でもあります。このことから、肝臓への過度のストレスはしばしば代謝異常として現れます。以上より、肝免疫系の不全が糖代謝異常や脂質代謝異常をもたらすと言うことは容易に想像が付きます。
我々は、食事・栄養摂取がもたらす肝臓への影響と、肝免疫との関係を研究しています。
2.これまでの研究概要
現代人の生活スタイルにより発症が促進される生活習慣病は、現代社会における大きな問題となっている。その代表的なものである高血圧・脂質異常症・糖尿病・肥満はそれら自体が生命にかかわる重篤な結果を引き起こしうるのに加え、また近年これらの背景のもとでの発症が注目されてきたNAFLD(非アルコール性脂肪性肝障害)やNASH(非アルコール性脂肪性肝炎)、あるいはこれらから進展発症する肝癌も生活習慣病の範疇の中で大きな位置を占めるようになってきた。これらの発症要因となる因子は、偏食、運動不足、喫煙、ストレスなど多く知られているが、これらの因子に対してどのような反応が生体内に起こり、疾病発症へ至るのかについては、これまで多くの研究がなされてきているが、未解明な部分も多い。生活習慣病を引き起こしうる遺伝子異常は複数報告されており、我々が単離同定したヌクリングもその一つである。ヌクリング遺伝子発現不全は、生活習慣病にカテゴライズされる種々の炎症性疾患の発症率を上昇させることがマウスの系で確認されている。ヌクリングはまたストレスにより、発現の影響を受けることが我々の研究で明らかとなってきている。ヌクリングは新規アポトーシス制御分子であり、マクロファージ系の細胞、特に肝在住マクロファージであるクッパー細胞の活性化やアポトーシスに関与しているらしいことを我々は明らかにしてきた。クッパー細胞の動態は炎症性肝疾患の発症に強い影響を及ぼすことが考えられる。このことから、環境の変化に伴うヌクリング自身の発現変動が生活習慣病の発症に影響している可能性が示唆される。ヌクリングの発現制御とそれに伴う生活習慣病の発症機構が明らかとなれば、同疾病に対する新たな治療戦略の開発への発展も期待される。

ヌクリング: マウスヌクリング遺伝子は全長1411アミノ酸をコードし、またその配列中にはアンキリンリピート、ロイシンジッパーモチーフ及び二つのt-SNARE コイルドコイルドメインといったタンパク質間相互作用に重要と思われる複数のモチーフが同時に存在する構造を有する(Sakai et al. J. Biochem. 2003, JB論文賞)。これまでの研究成果より、我々は本遺伝子のコードする蛋白分子が細胞傷害性ストレス時に誘導される複数の細胞死(アポトーシス)誘導情報伝達経路を制御していることを示す知見を得ている。ヌクリングは種々の細胞外ストレスにより細胞内に発現が誘導され、アポトーシス誘導分子Apaf-1と分子間相互作用して、そのアポトーシス誘導時の核移行及び細胞内発現を制御することにより、Apaf-1/カスパーゼ9 経路(アポトゾーム経路)の活性化に関与している(図中(2))(Sakai et al. J. Biol. Chem. 2004)。さらに、 Nuclear factor-B (NF-B)とも相互作用し、その核移行を制御することにより、NF-Bの標的である種々のアポトーシス関連遺伝子(ガレクチン3等)の転写活性を制御している(図中(3))(Liu, Sakai et al. FEBS J. 2009)。また、抗アポトーシス分子ガレクチン3との相互作用により、アポトーシス抑制経路の制御にも関与が強く示唆されている(図中(1)) (Biochem. J. 2004)。一方、ヌクリング自身がその標的であるNF-Bの転写活性によって発現誘導され、アポトーシス誘導因子として働いた後にプロテアソーム及びカスパーゼ系により分解されることを我々は明らかにした(Tran et al. J. Biochem. 2010)。このことより、細胞は傷害性ストレスにさらされると最初はNF-Bの活性化により抵抗性を示すが、持続的ストレス下ではヌクリングの発現が誘導され、アポトーシスの方へ傾くというモデルが考えられた。実際にヌクリングの欠損は細胞傷害性ストレスに対してアポトーシス障害を引き起こすことが個体レベルで種々、確認されている(Kim et al. J. Biochem. 2013)。ヌクリングの関与が示唆されるNF-B経路は、近年発がん機構への関与が注目されてきている。我々は、ヌクリングの発現異常が潜在的に乳がんを発症しやすくなることを見いだし、そのことから離乳後の乳腺退縮時のアポトーシス現象にヌクリングが重要であることを証明し、これを報告した(Dang et al. J Biol. Chem. 2015)。また肝炎に伴う肝がんの発症機構においては、肝実質細胞及びクッパー細胞におけるNF-Bの活性化及びそれに伴うアポトーシス抑制が極めて重要な役割を担っていることが明らかとなってきている。ヌクリングKOマウスでは初代培養胚性線維芽細胞においてNF-Bの持続的活性化が観察されていたが (Liu, Sakai et al. Biochem. J. 2004)、生体肝組織においても多くのヌクリングKOマウス個体においてNF-Bの持続的活性化を最近確認している。また、同KOマウスでは肝炎・肝がんの自然発症率が生後一年を経過した集団で著増することが観察されている。最近我々はこれらヌクリングKOマウスに於ける炎症性肝疾患発症の下地として、NF-B活性化異常に起因すると考えられる代謝障害が存在していることを見いだした。我々はこのヌクリング−NF-B経路による肝代謝調節機構の解明を目指して研究を行っている。
主 要 論 文
1. Dang HV, Sakai T, Pham TA, Tran DH, Yorita K, Shishido Y, Fukui K. Nucling, a novel apoptosis-associated protein, controls mammary gland involution by regulating NF-κB and STAT3. J Biol Chem. 290巻40号, 2015、24626-24635 DOI:10.1074/jbc.M115.673848
2. Tran DH, Shishido Y, Chung SP, Trinh HT, Yorita K, Sakai T, Fukui K. Identification of DNA-binding proteins that interact with the 5'-flanking region of the human d-amino acid oxidase gene by pull-down assay coupled with two-dimensional gel electrophoresis and mass spectrometry. J Pharm Biomed Anal. 116巻, 2015、94-100 DOI:10.1016/j.jpba.2015.02.031.
3. Tran DH, Shishido Y, Chung SP, Trinh HT, Yorita K, Sakai T, Fukui K. Identification of two promoters for human D-amino acid oxidase gene: implication for the differential promoter regulation mediated by PAX5/PAX2. J Biochem. 157巻5号、2015、377-387 DOI:10.1093/jb/mvu084
4. 福井 清、宍戸 裕二、頼田 和子、坂井 隆志、D-アミノ酸代謝の病態システム酵素学:統合失調症疾患感受性とD-アミノ酸酸化酵素、月刊バイオインダストリー 31巻、2014、11-16
5. Kim SM, Sakai T, Dang HV, Tran NH, Ono K, Ishimura K, Fukui K. Nucling, a novel protein associated with NF-κB, regulates endotoxin-induced apoptosis in vivo. J Biochem. 153巻1号、2013、93-101.
| 研究室紹介::坂井 隆志 | 05:46 PM | comments (x) | trackback (x) |

